Lehrbuch Lyme-Borreliose
12 |
Lyme-Neuroborreliose (LNB) |
Der Begriff Lyme-Neuroborreliose bezeichnet das Vorliegen neurologischer Krankheitsmanifestationen bei der Lyme-Borreliose. Es wird unterschieden zwischen einer akuten Neuroborreliose und einer
chronischen Neuroborreliose (Stadium III). Betroffen sind das zentrale und/oder periphere Nervensystem.
In Leitlinien verschiedener Fachgesellschaften wird darauf hingewiesen, dass neben den klinischen Manifestationen auch neurochemische und serologische Parameter zu beachten sind. Unter
neurochemischen Parameter werden im Wesentlichen ein entzündlicher Liquor und intrathekale Antikörper verstanden, die insbesondere einen wichtigen Stellenwert bei den diagnostischen Kriterien
haben. Zu beachten ist jedoch, dass diese Laborparameter nur bestimmte Formen der Lyme-Neuroborreliose betreffen. Ein entzündlicher Liquor tritt bei der Meningitis auf. Die Bildung intrathekaler
Antikörper sind die Antwort des ZNS-eigenen Immunsystems auf den Befall durch Borrelia burgdorferi; intrathekale Antikörper treten also nur bei entzündlichen Vorgängen im zentralen Nervensystem
auf oder bei Läsionen nervaler Strukturen innerhalb des Subarachnoidalraumes. Intrathekale Antikörper fehlen daher bei Erkrankung des peripheren Nervensystems, also bei der Polyneuropathie, nicht
selten auch bei der craniellen Neuropathie, wenn keine sogenannte Begleitmeningitis vorliegt und bei der Neuroradiculitis, bei der sie nur bei Krankheitsläsion innerhalb des Subarachnoidalraumes
zu erwarten sind. – Die Annahme, dass eine Lyme-Neuroborreliose mit einer Dauer von mindestens 2 bis 3 Monaten stets mit einer Seropositivität einhergeht, geht allein auf die Arbeit von Hansen
und Lebech, 1992 (78) zurück und entspricht nicht zahlreichen anderslautenden Befunden in der Literatur. Bezüglich weiterer Einzelheiten sei auf das Kap. 21.14, verwiesen.
Neurologische Manifestationen treten bei der Lyme-Borreliose in etwa 15-20% der Fälle auf. Daher ist eine Lyme-Neuroborreliose für die Diagnose einer Lyme-Borreliose, die andere Organe (außer
Nervensystem) betrifft, nicht obligat. Eine Lyme-Borreliose, insbesondere im Stadium III, kann also wegen einer fehlenden Lyme-Neuroborreliose nicht ausgeschlossen werden.
Bei der Lyme-Neuroborreliose im Spätstadium (chronische LNB, Stadium III) können dieselben Manifestationen wie bei der akuten Neuroborreliose vorliegen; die chronische LNB (Stadium III) ist
jedoch durch weitere Krankheitserscheinungen gekennzeichnet (vgl. Tab. 12.1).

Die Manifestationen der Lyme-Neuroborreliose sind in Tabelle 12.1 dargestellt. Die durch Borrelien-Infektion hervorgerufenen Krankheitsbilder ähneln weitgehend neurologischen Krankheitszuständen
anderer Genese. So wird zum Beispiel eine periphere Facialisparese bei Lyme-Borreliose sich phänomenologisch nicht von einer sogenannten idiopathischen Facialisparese unterscheiden. Im Hinblick
auf differentialdiagnostisch zu beachtende neurologische Infektionskrankheiten kann pauschal festgestellt werden, dass Borrelia burgdorferi im Vergleich zu anderen Bakterien und zum Teil auch
gegenüber neurotropen Viren eine vergleichsweise geringe Virulenz aufweist. So ist die Krankheitsausprägung einer Meningitis infolge Infektion mit Streptococcus pneumoniae ausgeprägter als bei
der akuten Lyme-Borreliose. Gleiches gilt zum Beispiel auch für den oft vergleichsweise schweren Krankheitsverlauf einer Frühsommer-Meningoencephalitis, die in Krankheitsausprägung, Mortalität
und Krankheitsfolgen dramatischer verläuft als die Lyme-Neuroborreliose. Dennoch kann die Lyme-Neuroborreliose eine schwere Beschwerdesymptomatik verursachen und erhebliche Krankheitsfolgen nach
sich ziehen.
Einige Krankheitsbilder der Lyme-Neuroborreliose haben allerdings spezifischen Charakter. Dies gilt zum Beispiel für die Neuroradiculitis (M. Bannwarth) oder auch für eine isolierte passagere
bzw. nicht progrediente Myelitis.
Entzündliche Erkrankungen im zentralen Nervensystem, also im Wesentlichen in der Form einer Encephalitis oder Myelitis, treten sowohl im Früh- als auch im Spätstadium der Lyme-Neuroborreliose
auf. In 60% der Fälle manifestiert sich die Lyme-Neuroborreliose im zentralen Nervensystem als cervicale oder thorakale Myelitis mit entsprechenden motorischen und sensorischen Defiziten. Solche
Manifestationen infolge Myelitis zeigen eine große Spannbreite von diskreten Paresen bis zu ausgeprägten Tetra- oder Paraparesen und unterschiedlich ausgeprägten sensiblen Querschnitts-Syndromen.
Die Neuroradiculitis wurde 1941, also vor Entdeckung der Lyme-Borreliose, von Bannwarth beschrieben (1). Der Morbus Bannwarth ist die häufigste Krankheitsmanifestation der Lyme-Neuroborreliose
und kann in der Frühphase, jedoch auch im Spätstadium (Stadium III) auftreten.
Die Neuroradiculitis kann sich in allen Nervenwurzeln entwickeln, d.h. cervical, thorakal und lumbosacral.
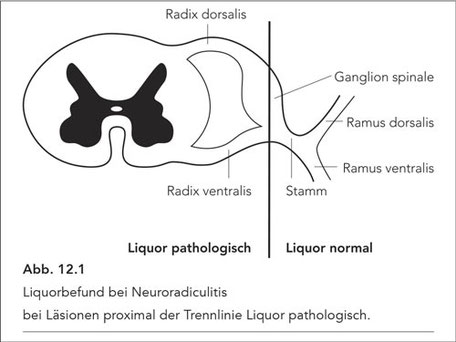
Häufig, aber nicht immer, ist der Liquor entzündlich verändert und in den Läsionen sind lymphoplasmozytäre Infiltrate nachweisbar (2).
Ein pathologischer Liquor ist zu erwarten, wenn die Läsion innerhalb des Subarachnoidalraumes (intraspinal), bei den außerhalb gelegenen Strukturen (extraspinal), nicht aber bei Prozessen in den außerhalb gelegenen Strukturen liegt (vgl. Abb. 12.1).
Bezüglich der pathologischen Anatomie, d.h. der Zuordnung motorischer und sensibler Defizite oder Zuordnung einzelner Nervenwurzeln, sei auf die Abb. 12.2 - 12.5 verwiesen. Die Auswirkungen verschieden lokalisierter Neuroradikulitiden auf das Verhalten der Muskeleigenreflexe sind in Tabelle 12.2 wiedergegeben. Die Differentialdiagnose wird in Tab. 12.3 dargestellt.
Symptomatisch ist die Neuroradiculitis gekennzeichnet durch Schmerz, motorische Defizite und Sensibilitätsstörungen. Diese Manifestationen treten in einem Teil der Fälle einzeln auf, kommen
jedoch häufig in Kombination vor. Diagnostisch entscheidend ist die segmentale Zuordnung. Bei länger bestehender polysegmentaler Polyneuritis können sich Muskelatrophien in den abhängigen
Regionen entwickeln. Besonders charakteristisch und für den Patienten belastend ist der radiculäre Schmerz beim M. Bannwarth. Die Schmerzen sind meist sehr ausgeprägt mit Zunahme der
Schmerzintensität während der Nacht. Schmerzcharakter und -intensität sind von einer traumatisch bedingten Neuroradiculitis, also in der Regel bei Bandscheibenvorfall, nicht zu unterscheiden.
Überhaupt ist die Differentialdiagnose infektiös-bedingte Neuroradiculitis (M. Bannwarth)/Bandscheibenvorfall von besonderer Bedeutung; häufig wird der M. Bannwarth als Bandscheibenvorfall
fehldiagnostiziert. Eine sorgfältige anatomische Zuordnung der Lokalisation von Beschwerden und Befunden zu der Lokalisation im bildgebenden Verfahren (MRT) ist von erheblicher Bedeutung;
allerdings sind auch die anderen klinischen Daten (Anamnese, körperlicher Untersuchungsbefund, medizinisch-technische Befunde) zu beachten.
Die segmentale bzw. sensible Zuordnung (Myotome, Dermatome) sind in den Abbildungen 12.2 - 12.5 dargestellt.
Differentialdiagnostisch ist die infektiöse Neuroradiculitis (M. Bannwarth) insbesondere von einer mechanischen Neuroradiculitis, d.h. von einem Bandscheibenvorfall, differentialdiagnostisch
abzugrenzen. Sonstige Differentialdiagnosen sind in Tabelle 12.3 dargestellt.


Die Behandlung der Neuroradiculitis erfolgt in der Regel mit intravenös applizierten Cephalosporinen der dritten Generation, mit Therapieversagern ist jedoch zu rechnen (3-6). Da die
Cephalosporine allerdings nur extrazellulär wirksam sind, empfiehlt sich die Kombination mit Minocyclin als intrazellulär wirksamer Substanz und Tinidazol zur Bekämpfung von Biofilmen und
zystischen Formen.
Die infektiös ausgelöste Neuroradiculitis kann sich auf die nachgeordneten nervalen Strukturen ausdehnen, d.h. auf Plexus und hieraus abgehenden Nerven.
Es entwickeln sich die Krankheitsbilder einer Plexopathie, Mononeuritis oder Mononeuritis multiplex. Das neurologische Krankheitsbild kann bei dieser Erkrankungslokalisation vielgestaltig
sein.
Schädigungen des Plexus brachialis und lumbosacralis bei Lyme-Neuroborreliose sind in der Literatur nur als Einzelfälle beschrieben (7, 8). Nach Erfahrungen des Verfassers sind Plexopathien
jedoch keinesfalls eine Rarität.
Das klinische Bild der Plexopathien ist bei Betrachtung der anatomischen Strukturen leicht nachvollziehbar.
Die Anatomie des Plexus brachialis ist in Abb. 12.2 dargestellt. Der Plexus brachialis hat seinen Ursprung in den Nervenwurzeln C5 bis TH1. Die Nerven gehen in die Primär- und Sekundärstränge über und münden schließlich in folgende wesentliche Nerven, die die obere Extremität versorgen:
- N. musculocutaneus
- N. radialis
- N. medianus
- N. ulnaris
Aus den Primär- und Sekundärsträngen gehen zudem Nerven ab, die den oberen Brustkorb- und Rückenbereich versorgen sowie die sensiblen Äste des N. cutaneus brachii medialis und N. cutaneus antebrachii medialis.
Entsprechend der Lokalisation entzündlicher Schädigungen im Bereich des Plexus brachialis zeigt das klinische Bild fließende Übergänge zwischen einer Neuroradiculitis und Entzündungen peripherer
Nerven (Mononeuritis oder Mononeuritis multiplex); bei einer Vielzahl von Schädigungen kann sich ein sehr amorphes, oft anatomisch nicht mehr eindeutig differenzierbares Krankheitsbild mit
motorischen und sensiblen Störungen zeigen. Ein typisches Symptom ist auch eine mehr oder weniger ausgeprägte Muskelatrophie im Bereich des Schultergürtels und des Armes.
Die verschiedenen motorischen Funktionen im Bereich der oberen Extremität und ihre Zuordnung zu Nervenwurzeln und peripheren Nerven sind in Tabelle 12.4 dargestellt.
Die Anatomie des Plexus lumbosacralis ist in Abb. 12.3 dargestellt. Er hat seinen Ursprung in den Nervenwurzeln L1-L5 und S1-S4. Die rami spinales gehen in mehr oder weniger verflochtene Äste über, aus denen sich die verschiedenen peripheren Nerven bilden, die insbesondere die untere Extremität versorgen.
Die wichtigsten motorischen Funktionen in Zuordnung zu den Nervenwurzeln und peripheren Nerven sind in Tabelle 12.5 dargestellt.
Sensible Störungen und radiculäre Schmerzen können bei der Neuroradiculitis den entsprechenden Segmenten (Dermatomen) zugeordnet werden. Eine solche segmentale Zuordnung ist eine wesentliche Basis für die Diagnose einer Neuroradiculitis (Abb. 12.4, 12.5).
Wie im Prinzip bereits dargestellt, bestimmen Anzahl und Lokalisation der entzündlichen Schädigungen im Bereich des Plexus lumbosacralis das klinische Bild. Oft zeigt sich ein fließender Übergang
von einer radiculären Symptomatik (Neuroradiculitis) zur Plexitis, Mononeuritis und Mononeuritis multiplex. Entsprechend besteht eine vielfältige neurologische Symptomatik in Form von
asymmetrischen focalen Paresen, Schmerzen, Taubheit, Dysästhesie und Parästhesien in mehr oder weniger bestimmbarer Zuordnung zu den radiculären Etagen.
Auch können Muskelatrophien auftreten; allerdings führt eine Neuroradiculitis selbst bei einer weitgehenden Lähmung nicht zwangsläufig zu einer Muskelatrophie, vielmehr ist in einer solchen
Konstellation eine Hypertrophie in der Literatur beschrieben (9).
Die diagnostischen Maßnahmen bei Plexopathie ergeben sich aus den pathophysiologischen Ursachen (siehe Tab. 12.6).
Eine weitere häufige Krankheitsmanifestation der Lyme-Neuroborreliose stellen die craniellen Neuropathien dar. Alle Hirnnerven können bei der LB betroffen sein, allerdings in einem überwiegenden
Teil von etwa 80% betrifft dies den N. facialis.
Bezüglich der Symptomatik der Hirnnervenläsionen sei auf die Tabelle 12.7 verwiesen.
Die Polyneuropathie ist (nach Erfahrung des Verfassers) eine häufige Manifestation der Lyme-Neuroborreliose. Studien über die Häufigkeit liegen nicht vor. Überhaupt ist die Literatur zur
Polyneuropathie bei LNB relativ spärlich (10-15).
Die Polyneuropathie tritt mehr oder weniger symmetrisch auf, meistens im Bereich der unteren Extremitäten, entweder ausschließlich mit sensiblen Symptomen oder als sensomotorische
Polyneuropathie. Meistens lässt sich ein axonal-demyelinisierender Prozess nachweisen.
Die Polyneuropathie kann über viele Jahre bei stetiger Progredienz zu erheblicher Krankheitsausprägung und Behinderung führen.
Der Liquor ist bei der Polyneuropathie unauffällig (14, 15). Die mitunter in der Literatur geäußerte Ansicht, dass die Polyneuropathie nur in Verbindung mit einer Acrodermatitis chronica
atrophicans (ACA) auftritt, ist unzutreffend; dies ist durch mehrere Publikationen belegt (10, 11, 14, 15).








Die Lyme-Borreliose kann zu einem breiten Spektrum psychiatrischer Erkrankungen führen: Paranoia, Demenz, Schizophrenie, bipolare Störung, Angststörung, Depression, Anorexie, Autismus und OCD
(„Obsessive Compulsive Disorder“) (16-35).
Depressive Zustände sind sehr häufig und kommen nach verschiedenen Studien in 26% bis 66% der Fälle vor.
Neben diesen mentalen Störungen ist die Beeinträchtigung der Kognition eine häufige Manifestation der Lyme-Borreliose (sogenannte Encephalopathie).
Ein besonderes Problem der Lyme-Neuroborreliose ist die oft erhebliche Einschränkung kognitiver Leistungsfähigkeit bei Kindern mit drastischen Auswirkungen auf die Schulbildung (11, 12).
Auch hochgradige neurodegenerative Erkrankungen sind im Zusammenhang mit der Lyme-Borreliose beschrieben (36-53). Dies betrifft insbesondere Parkinson-ähnliche Krankheitszustände und die Demenz.
Die Zusammenhänge sind durch Post-Mortem-Untersuchungen belegt (36, 37).
Cerebrale Läsionen sind bei der Lyme-Borreliose bzw. Lyme-Neuroborreliose ein häufig beobachtetes Phänomen (54-63). Die Läsionen stellen sich im CT als hypodense und im MRT als hyperdense Herde
dar. Ursache sind Gewebsschädigung und nachfolgende Narbenbildung (Glioseherde), die im Wesentlichen durch Parenchymschädigung infolge Durchblutungsstörung oder durch entzündliche Prozesse im
Hirnparenchym zustande kommen.
Die Läsionen sind nicht spezifisch für eine Lyme-Borreliose, sie kommen auch bei anderen Erkrankungen vor (Ischämie, SLE, Behcet-Krankheit, sonstige Vasculitiden, humanes T-Zell-Leukämie-Virus-I,
Sarkoidose).
Auch bei aktuell gesunden Personen werden derartige Läsionen gelegentlich beobachtet. Dies bedeutet jedoch nicht, dass die Läsionen ohne Krankheitsbedeutung wären. Vielmehr muss in solchen Fällen
angenommen werden, dass vorausgegangene (unbemerkte) Erkrankungen zu den Läsionen führten. Die Läsionen stellen also nicht etwa eine Normvariante bei Gesunden dar (54, 57).
Der im medizinischen Alltag oft benutzte Ausdruck „unspezifische Läsionen“ impliziert also im Wesentlichen, dass die Ursache unklar ist. Daher müsste nicht von „unspezifischen Läsionen“, sondern
von „Läsionen ungeklärter Ursache“ gesprochen werden.
Der Vollständigkeit halber sei angemerkt, dass bei der Lyme-Neuroborreliose gelegentlich auch Läsionen im kortikalen Bereich vorkommen. Dies ist im Zusammenhang mit einer entsprechenden Anamnese,
einer zutreffenden Beschwerdesymptomatik und bei Beachtung der Differentialdiagnose ein wesentlicher Hinweis auf die Lyme-Neuroborreliose (Erfahrungen des Verfassers, unveröffentlicht).
In der Literatur beschrieben ist der Zusammenhang zwischen Lyme-Borreliose und Karpaltunnelsyndrom (64). Nach eigenen (unveröffentlichten) Erfahrungen kann die Lyme-Borreliose auch zu einem
Sulcus ulnaris-Syndrom oder zu einem Canalis ulnaris-Syndrom (Guyon-Loge-Syndrom) mit entsprechender neurologischer Symptomatik führen.
Der Liquor zeigt bei der Lyme-Neuroborreliose unspezifische und spezifische Veränderungen (Tab. 12.8) Unspezifische Veränderungen sind im Wesentlichen die Parameter eines entzündlichen Liquors: Pleozytose, erhöhtes Protein, Albumin und IgG. Als spezifischer Parameter gelten intrathekale Antikörper, d.h. Antikörper gegen Bb, die vom ZNS selbst gebildet werden. Bei der akuten Lyme-Neuroborreliose sind all diese Parameter in der Regel erhöht, allerdings können sich die intrathekalen Antikörper mit zeitlicher Verzögerung bis zu 6 Wochen entwickeln; auch wird in der Literatur beschrieben, dass in einem Teil der Fälle (20%) intrathekale Antikörper nicht nachweisbar sind. Besondere Bedeutung bei der akuten Lyme-Neuroborreliose hat der Nachweis von intrathekalen IgM-AK (76).
Oligoklonale Banden (OB) kommen bei zahlreichen entzündlichen Erkrankungen vor und tragen zur Differenzierung zwischen Lyme-Neuroborreliose und anderen entzündlichen Erkrankungen des ZNS nicht
bei. Theoretisch kann durch Nachweis von OspA und des Krankheitserregers im Liquor weitere diagnostische Sicherheit erlangt werden, diese Methoden gehören jedoch nicht zur Routinediagnostik. Das
Gleiche gilt für CXCL13.
Bei der Lyme-Neuroborreliose geht ein Teil der Krankheitszustände mit Liquorveränderungen, ein anderer Teil ohne Liquorveränderungen einher (Tab. 12.9).
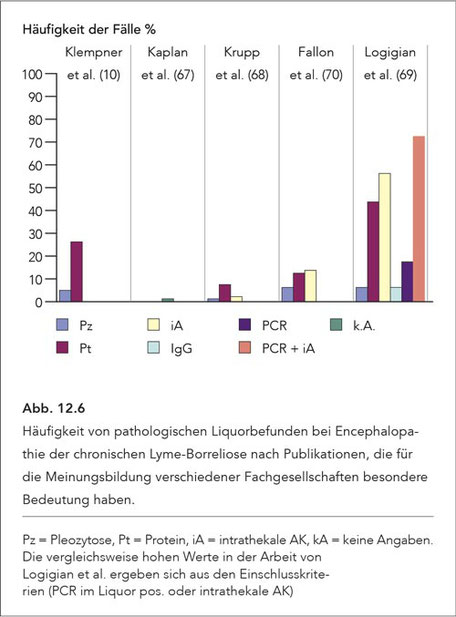
Der Liquor weist bei der Lyme-Borreliose im Stadium III nur in etwa 5% der Fälle pathologische Veränderungen auf und dies in nur geringer Ausprägung (Abb. 12.6). Ausnahmen ergeben sich lediglich,
wenn bei der Lyme-Borreliose im Stadium III aktuell relevante entzündliche Veränderungen im zentralen Nervensystem, insbesondere in Form der Meningitis, vorliegen. Ein unauffälliger Liquor
spricht folglich nicht gegen eine Lyme-Borreliose Stadium III. Da Veränderungen dieser Situation selten sind, ist eine Lumbalpunktion zwecks Liquoruntersuchung bei der Lyme-Borreliose im Stadium
III nicht indiziert, es sei denn, dass aufgrund der klinischen Symptomatik eine akute Entzündung des zentralen Nervensystems anzunehmen ist.
Eine Lyme-Neuroborreliose kann auch bei Seronegativität vorliegen. Es gibt einige Publikationen, die eindeutig pathologische Liquorveränderungen, einschließlich intrathekaler Antikörper zeigen,
bei denen jedoch Antikörper im Serum nicht nachweisbar waren (Seronegativität im Blut).
Eine besonders schwierige Differentialdiagnose betrifft die Unterscheidung Multiple Sklerose (MS)/Lyme-Neuroborreliose (LNB) Ein wesentliches Handicap für die Differenzierung MS/LNB ist die
Tatsache, dass derzeit für beide Krankheiten kein positiver Krankheitsmarker zur Verfügung steht, d.h. es gibt keine medizinisch-technische Untersuchung, insbesondere keine Laboruntersuchung, die
bei positivem Ausfall die jeweilige Krankheit beweisen würde. Die Diagnose beider Krankheiten muss sich daher auf die klinischen Daten, d.h. auf Anamnese, körperlichen Untersuchungsbefund, die
medizinisch-technischen Befunde und die Differentialdiagnose stützen.
Die MS tritt in 90% der Fälle als schubförmige Krankheit auf („Relapsing Remitting MS“, RRMS) und in 10% als primär progressive Erkrankung „(Primary Progressive MS“, PPMS). Für beide
Verlaufsformen wurden diagnostische Kriterien festgelegt (McDonald-Kriterien). Werden diese Kriterien erfüllt, ist die Voraussetzung für die Diagnose einer MS gegeben, jedoch ist das Vorliegen
der McDonald-Kriterien kein Beweis für die MS.
Die Differentialdiagnose basiert im Wesentlichen auf den Unterschieden im Krankheitsverlauf. Die RRMS zeigt Schübe und zwischenzeitlich beschwerdefreie Intervalle, die PPMS eine stetige
Progredienz. Dagegen ist das neurologische Defizit bei der chronischen LNB meistens permanent vorhanden mit Schwankungen in der Ausprägung und ggf. mit Ausheilung bei mehr oder weniger
ausgeprägten Schädigungsfolgen (vgl. Abb. 12.7).
Ein entzündlicher Liquor oder gar der Nachweis von intrathekalen Antikörpern gegen Bb sprechen für eine LNB, da der Liquor bei der MS meist nicht wesentlich verändert ist. Der Nachweis von
oligoklonalen Banden (OB) ist bei der Differentialdiagnose nicht hilfreich, da er in beiden Krankheiten (MS, LNB) vorkommt. Überdies wurde der Liquorbefund aus den McDonald-Kriterien, also den
MS-Kriterien, eliminiert.



Die sehr komplizierte Differentialdiagnose und Sonderformen der MS, die ebenfalls eine Abgrenzung gegenüber der LNB erfordern, sind an anderer Stelle detailliert dargestellt (77).
Schließlich sei noch eine seltene Manifestation der LNB genannt, nämlich der Pseudotumor cerebri (65-72). Hierbei handelt es sich um eine intracranielle Hypertension ohne wesentliche Erweiterung
der Seitenventrikel (also kein wesentlicher Hydrocephalus). Die führenden Symptome sind Kopfschmerzen, Sehstörungen, Tinnitus, Doppelbilder, insbesondere Abducensparese und Papillenödem. Das
Krankheitsbild ist auch im Zusammenhang mit anderen Infektionskrankheiten beschrieben, z.B. der Syphilis und in Form von Einzelfallbeschreibungen auch bei der Lyme-Borreliose.
Ein besonderes Problem bei der Lyme-Borreliose ist die sogenannte Encephalopathie (25,73-75). Der Begriff beschreibt kognitive und mentale Störungen, die sehr häufig bei der Lyme-Borreliose im
Stadium III auftreten. In neuropsychologischen Testverfahren lassen sich diese kognitiven Störungen oft nicht nachweisen, wohl aber bei systematischer Untersuchung nach Selbsteinschätzung auf der
Basis standardisierter Testverfahren. Die Encephalopathie ist nicht selten wesentliche Ursache für eine Berufsunfähigkeit und bei Kindern für Lernschwierigkeiten im schulischen Bereich.
Zu orientierenden Informationen bezüglich Pathophysiologie und pathologischer Anatomie der Lyme-Neuroborreliose wird auf das Kap. 12.6 (Literaturübersicht LNB, Pathophysiologie und -anatomie)
verwiesen.
- Literaturverzeichnis
-
- Bannwarth A. Chronische lymphozytäre Meningitis, entzündliche Polyneuritis und Rheumatismus. Arch Psychiatr Nervenkr. 1941; 113:284-376.
- Miklossy J. Chronic or Late Lyme Neuroborreliosis: Analysis of Evidence Compared to Chronic or Late Neurosyphilis. The Open Neurology Journal. 2012; 6(1-M9):146-157.
- Dattwyler RJ, Halperin JJ, Pass H, Luft BJ. Ceftriaxone as effective therapy in refractory Lyme disease. J Infect Dis. 1987; 155:1322-1325.
- Karlsson M, Hammers-Berggren S, Lindquist I, Stiernstedt G, Svenungsson B. Comparison of intravenous penicillin G and oral doxycycline for treatment of Lyme neuroborreliosis. Neurology. 1994; 1203-1207.
- Mullegger RR, Millner MM, Stanek G, Spork KD. Penicillin G sodium and ceftriaxone in the treatment of neuroborreliosis in children – a prospective study. Infection. 1991; 19:279-283.
- Pfister HW, Preac-Mursic V, Wilske B, Schielke E, Sorgel F, Einhaupl KM. Randomized comparison of ceftriaxone and cefotaxime in Lyme neuroborreliosis. J Infect Dis. 1991; 163:311-318.
- Jalladeau E, Pradat PF, Maisnobe T, Léger JM. [Multiple mononeuropathy and inflammatory syndrome manifested in Lyme disease]. Rev Neurol (Paris) 2001; 157(10):1290-2.
- Faul JL, Ruoss S, Doyle RL, Kao PN. Diaphragmatic paralysis due to Lyme disease. Eur Respir J. 1999; 13(3):700-2.
- Mielke U, Ricker K, Emser W, Boxler K. Unilateral calf enlargement following S1 radiculopathy. Muscle Nerve. 1982; 5:434.
- Logigian EL, Kaplan RF, Steere AC. Chronic neurologic manifestations of Lyme disease. N Engl J Med. 323(21):1438-44; 1990.
- Halperin JJ, Little BW, Coyle PK, Dattwyler RJ. Lyme disease: cause of a treatable peripheral neuropathy. Neurology. 37(11):1700-6; 1987.
- Kindstrand E, Nilsson BY, Hovmark A, Nennesmo I, Pirskanen R, Solders G, Asbrink E. Polyneuropathy in late Lyme borreliosis – a clinical, neurophysiological and morphological description. Acta Neurol Scand. 101(1):47-52; 2000.
- Kindstrand E, Nilsson BY, Hovmark A, Pirskanen R, Asbrink E. Peripheral neuropathy in acrodermatitis chronica atrophicans –effect of treatment. Acta Neurol Scand. 106(5):253-7; 2002.
- Mygland A, Skarpaas T, Ljostad U. Chronic polyneuropathy and Lyme disease. Eur J Neurol. 13(11):1213-5; 2006.
- Logigian EL und Steere AC. Clinical an electrophysiologic findings in chronic neuropathy of Lyme disease. Neurology. 1992; 42(2):303-11.
- Keilp JG, Corbera K, Slavov I, Taylor MJ, Sackeim HA, Fallon BA. WAIS-III and WMS-III performance in chronic Lyme disease. J Int Neuropsychol Soc. 2006; 12(1):119-29.
- Sherr VT. Panic attacks may reveal previously unsuspected chronic disseminated lyme disease. J Psychiatr Pract. 2000; 6(6):352-6.
- Barr WB, Rastogi R, Ravdin L, Hilton E. Relations among indexes of memory disturbance and depression in patients with Lyme borreliosis. Appl Neuropsychol. 1999; 6(1):12-8.
- Kaplan RF, Jones-Woodward L, Workman K, Steere AC, Logigian RL, Meadows ME. Neuropsychological deficits in Lyme disease patients with and without other evidence of central nervous system pathology. Appl Neuropsychol. 1999; 6(1):3-11.
- Bujak DI, Weinstein A, Dornbush RL. Clinical and neurocognitive features of the post Lyme syndrome. J Rheumatol. 1996; 23(8):1392-7.
- Ravdin LD, Hilton E, Primeau M, Clements C, Barr WB. Memory functioning in Lyme borreliosis. J Clin Psychiatry. 1996; 57(7):282-6.
- Fallon BA und Nields JA. Lyme disease: a neuropsychiatric illness. Am J Psychiatry. 1994; 151(11):1571-83.
- Fallon BA, Nields JA, Parsons B, Liebowitz MR, Klein DF. Psychiatric manifestations of Lyme borreliosis. J Clin Psychiatry. 1993; 54(7):263-8.
- Kaplan RF, Meadows ME, Vincent LC, Logigian EL, Steere AC. Memory impairment and depression in patients with Lyme encephalopathy: comparison with fibromyalgia and nonpsychotically depressed patients. Neurology. 1992; 42(7):1263-7.
- Krupp LB, Masur D, Schwartz J, Coyle PK, Langenbach LJ, Fernquist SK, Jandorf L, Halperin JJ. Cognitive functioning in late Lyme borreliosis. Arch Neurol. 1991; 48(11):1125-9.
- Swartfager W, Lanctot K, Rothenburg L, Wong A, Cappell J, Herrmann N. A Meta-Analysis of Cytokines in Alzeimer’s Disease. Biol Psychiatry. Biol Psychiatry. 2010; 68(10):930-41.
- Wallin A, Sjögren M, Edman A, Blennow K, Regland B. Symptoms, vascular risk factors and blood-brain barrier function in relation to CT white-matter changes in dementia. Eur Neurol. 2000; 44(4):229-35.
- Hájek T, Pasková B, Janovská D, Bahbouh R, Hájek P, Libiger J, Höschl C. Higher prevalence of antibodies to Borrelia burgdorferi in psychiatric patients than in healthy subjects. Am J Psychiatry. 2002; 159(2):297-301.
- Vázquez M, Sparrow SS, Shapiro ED. Long-term neuropsychologic and health outcomes of children with facial nerve palsy attributable to Lyme disease. Pediatrics. 2003; 112(2):e93-7.
- Adams WV, Rose CD, Eppes SC, Klein JD. Cognitive effects of Lyme disease in children: a 4 year followup study. J Rheumatol. 1999; 26(5):1190-4.
- McAuliffe P, Brassard MR, Fallon B. Memory and executive functions in adolescents with posttreatment Lyme disease. Appl Neuropsychol. 2008; 15(3):208-19.
- Tager FA, Fallon BA, Keilp J, Rissenberg M, Jones CR, Liebowitz MR. A controlled study of cognitive deficits in children with chronic Lyme disease. J Neuropsychiatry Clin Neurosci. 2001; 13(4):500-7.
- Fallon BA, Nields JA, Burrascano JJ, Liegner K, DelBene D, Liebowitz MR. The neuropsychiatric manifestations of Lyme borreliosis. Psychiatr Q. 1992; 63(1):95-117.
- Gaudino EA, Coyle PK, Krupp LB. Post-Lyme syndrome and chronic fatigue syndrome. Neuropsychiatric similarities and differences. Arch Neurol. 1997; 54(11):1372-6.
- Vrethem M, Hellblom L, Widlund M, Ahl M, Danielsson O, Ernerudh J, Forsberg P. Chronic symptoms are common in patients with neuroborreliosis - - a questionnaire follow-up study. Acta Neurol Scand. 2002; 106(4):205-8.
- Miklossy J. Emerging roles of pathogens in Alzheimer disease. Expert Rev Mol Med. 2011; 13:e30.
- Miklossy J. Alzheimer’s disease – a neurospirochetosis. Analysis of the evidence following Koch’s and Hill’s criteria. Journal of Neuroinflammation. 2011; 8:90.
- Miklossy J. Preface: Chronic inflammation and amyloidogenesis in Alzheimer’s disease – role of spirochetes. J Alzheimer Dis. 2008; 13(4):357.
- Balin BJ, Little CS, Hammond CJ, Appelt DM, Whittum-Hudson JA, Gérard HC, Hudson AP. Chlamydophila pneumoniae and the etiology of late-onset Alzheimer’s disease. J Alzheimer Dis. 2008; 13(4):371-80.
- Miklossy J. Chronic inflammation and amyloidogenesis in Alzheimer’s disease – role of spirochetes, J Alzheimer Dis. 2008; 13(4):381-91.
- Itzhaki RF, Wozniak MA. Herpes Simplex Virus Type 1 in Alzheimer’s disease: The Enemy Within. J Alzheimer Dis. 2008; 13(4):393-405.
- Hammer ND, Wang X, McGuffie BA, Chapman MR. Amyloids: Friend or Foe?. J Alzheimer Dis. 2008; 13(4):407-19.
- Urosevic N und Martins RN. Infection and Alzheimer’s disease: The ApoE e4 connection and lipid metabolism. J Alzheimer Dis. 2008; 13(4):421-35.
- Kamer AR, Dasanayake AP, Craig RG, Glodzik-Sobanska L, Bry M, de Leon MJ. Alzheimer’s disease and peripheral infections: The possible contribution from periodontal infections, model and hypothesis. J Alzheimer Dis. 2008; 13(4):437-49.
- Weinberg ED und Miklossy J. Iron withholding: a defense against disease. J Alzheimer Dis. 2008; 13(4):451-63.
- Kuntzer T, Bogousslavsky J, Miklossy J, Steck AJ, Janzer R, Regli F. Borrelia rhombencephalomyelopathy. Arch Neurol. 1991; 48(8):832-6.
- Miklossy J. Chronic inflammation and amyloidogenesis in Alzheimer’s disease – role of spirochetes. J Alzheimer Dis. 2008; 13(4):381-91.
- Miklossy J, Doudet DD, Schwab C, Yu S, McGeer EG, McGeer PL. Role of ICAM-1 in persisting inflammation in Parkinson disease and MPTP monkeys, Exp Neurol. 2006; 197(2):275-83.
- Miklossy J, Kis A, Radenovic A, Miller L, Forro L, Martins R, Reiss K, Darbinian N, Darekar P, Mihaly L, Khalili K.Beta-amyloid deposition and Alzheimer’s type changes induced by Borrelia spirochetes. Neurobiol Aging. 2006; 27(2):228-36.
- Miklossy J Khalili K, Gern L, Ericson RL, Darekar P, Bolle L, Hurlimann J, Paster BJ. Borrelia burgdorferi persists in the brain in chronic lyme neuroborreliosis and may be associated with Alzheimer disease. J Alzheimer Dis. 2004; 6(6):639-49.
- Miklossy J, Kasas S, Janzer RC, Ardizzoni F, Van der Loos H. Further ultrastructural evidence that spirochaetes may play a role in the aetiology of Alzheimer’s disease. Neuroreport. 1994; 5(10):1201-4.
- Miklossy J. Alzheimer’s disease – a spirochetosis? Neuroreport. 1993; 4(7):841-8.
- Miklossy J, Kuntzer T, Bogousslavsky J, Regli F, Janzer RC. Meningovascular form of neuroborreliosis: similarities between neuropathological findings in a case of Lyme disease and those occurring in tertiary neurosyphilis. Acta Neuropathol. 1990; 80(5):568-72.
- Agosta F, Rocca MA, Benedetti B, Capra R, Cordioli C, Filippi M. MR imaging assessment of brain and cervical cord damage in patients with neuroborreliosis. AJNR Am J Neuroradiol. 2006; 27(4):892-4.
- Tarasow E, Ustymowicz A, Zajkowska J, Hermanowska-Szpakowicz T. [Neuroborreliosis: CT and MRI findings in 14 cases. Preliminary communication]. Neurol Neurochir Pol. 2001; 35(5):803-13.
- Belman AL, Coyle PK, Roque C, Cantos E. MRI findings in children infected by Borrelia burgdorferi. Pediatr Neurol. 1992; 8(6):428-31.
- Krüger H, Heim E, Schuknecht B, Scholz S. Acute and chronic neuroborreliosis with and without CNS involvement: a clinical, MRI, and HLA study of 27 cases. J Neurol. 1991; 238(5):271-80.
- Morgen K, Martin R, Stone RD, Grafman J, Kadom N, HF McFarland, A Marques. FLAIR and magnetization transfer imaging of patients with post-treatment Lyme disease syndrome. Neurology. 2001; 57(11):1980-5.
- Halperin JJ, Luft BJ, Anand AK, Roque CT, Alvarez O, Volkmann DJ, Dattwyler RJ. Lyme neuroborreliosis: central nervous system manifestations. Neurology. 1989; 39(6):753-9.
- Fernandez RE, Rothberg M, Ferencz G, Wujack D. Lyme disease of the CNS: MR imaging findings in 14 cases. AJNR Am J Neuroradiol. 1990; 11(3):479-81.
- Demaerel P, Wilms G, Casteels K, Casaer P, Silberstein J, Baert AL. Childhood neuroborreliosis: clinicoradiological correlation. Neuroradiology. 1995; 37(7):578-81.
- Alto A, Sjöwall J, Davidsson L, Forsberg P, Smedby O. Brain magnetic resonance imaging does not contribute to the diagnosis of chronic neuroborreliosis. Acta Radio. 2007; 48(7):755-62.
- Agarwal R und Sze G. Neuro-lyme disease: MR imaging findings. Radiology. 2009; 253(1):167-73.
- Halperin JJ. Nervous system manifestation of Lyme disease. Rheum Dis Clin North Am. 1989; 25:635-647.
- Aboul-Enein F und Kristoferitsch W. Normal pressure hydrocephalus or neuroborreliosis? Wien Med Wochenschr. 2009; 159(1-2):58-61.
- Sibony P, Halperin J, Coyle PK, Patel K. Reactive Lyme serology in optic neuritis. J Neuroopthalmol. 2005; 25(2):71-82.
- Belman AL, Iyer M, Coyle PK, Dattwyler R. Neurologic manifestations in children with North American Lyme disease. Neurology. 1993; 43(12):2609-14.
- Zemel L. Lyme disease and pseudotumor. Mayo Clin Proc. 2000; 75(3):315.
- Kann L, Sood SK, Maytal J. Pseudotumor cerebri in Lyme disease: a case report and literature review. Pediatr Neurol. 1998; 18(5):439-41.
- Härtel C, Schilling S, Neppert B, Tiemer B, Sperner J. Intracranial hypertension in neuroborreliosis. Dev Med Child Neurol. 2002; 44(9):641-2.
- Steenhoff AP, Smith MJ, Shah SS, Coffin SE. Neuroborreliosis with progression from pseudotumor cerebri to aseptic meningitis. Pediatr Infect Dis J. 2006; 25(1):91-2.
- Halperin JJ, Steere AC, Shefner JM, Dashe JF, Thorner AR. Nervous system Lyme disease. UpToDate. 2011.
- Kaplan R, Trevino RP, Johnson GM, Levy L, Dornbush R, Hu LT, Evans J, Weinstein A, Schmid CH, Klempner MS. Cognitive function in post-treatment Lyme disease: do additional antibiotics help? Neurology. 2003; 60:1916-1922.
- McAuliffe P, Brassard MR, Fallon B. Memory and Executive Functions in Adolescents with Posttreatment Lyme Disease. Applied Neuropsychology. 2008; 15(3):208-19.
- Bloom BJ, Wyckoff PM, Meissner HC, Steere AC. Neurocognitive abnormalities in children after classic manifestations of Lyme disease. Pediatr Infect Dis J. 1998; 17(3):189-96.
- Reiber H, Ressel C B, Spreer A. Diagnosis of neuroborreliosis – Improved knowledge base for qualified antibody analysis and cerebrospinal fluid data pattern related interpretations. Neurochemical Laboratory, Department of Neurology, University Goettingen, Germany.
- Berghoff W. Differentialdiagnose Multiple Sklerose (MS)/Lyme-Neuroborreliose (LNB). www.praxis-berghoff.de.
- Hansen K und Lebech AM. The clinical and epidemiological profile of Lyme neuroborreliosis in Denmark 1985-1990. A prospective study of 187 patients with Borrelia burgdorferi specific intrathecal antibody production. Brain. 1992; 115:399-423.