Lehrbuch Lyme-Borreliose
14 |
Differentialdiagnose Multiple Sklerose/LNB |
Die Differentialdiagnose MS/LNB bezieht sich im Wesentlichen auf die Lyme-Neuroborreliose im Spätstadium (Stadium III, chronische Lyme-Neuroborreliose). Die Abgrenzung einer akuten
Lyme-Neuroborreliose (Stadium II) bereitet dagegen kaum differentialdiagnostische Probleme. Bei der folgenden Darstellung der Differentialdiagnose bezieht sich daher die Bezeichnung LNB auf die
Lyme-Neuroborreliose in ihrem chronischen Verlauf, also auf das Spätstadium.
Ein wesentliches Handicap für die Differenzierung MS/LNB ist die Tatsache, dass derzeit für beide Krankheiten kein positiver Krankheitsmarker zur Verfügung steht, d.h. keine
medizinisch-technische Untersuchung, insbesondere keine Laboruntersuchung, die bei positivem Ausfall die jeweilige Krankheit beweisen würde. Die Diagnose beider Krankheiten muss sich daher auf
die klinischen Daten, d.h. auf Anamnese, körperlichen Untersuchungsbefund und die medizinisch-technischen Befunde stützen.
Die Unterscheidung von MS und LNB setzt die Erkennung der Krankheitsgestalten dieser sich ähnelnden Krankheiten voraus. Bei der LNB ergeben sich diesbezüglich keine wesentlichen Schwierigkeiten,
während die Beschreibung der MS wegen der sehr diskrepanten wissenschaftlichen Literatur problematisch ist (vgl. 1, 2, 4, 7, 31, 50, 51, 52, 59).
Die pathophysiologischen Vorgänge im zentralen Nervensystem (ZNS) stimmen weitgehend überein, d.h. in beiden Fällen führt eine chronische oder wiederkehrende Entzündung zu Demyelinisierung und
Axondegeneration (31, 32, 33, 34, 35).
Entsprechend dieser pathophysiologischen Parallelität ergeben sich für die Krankheitsmanifestationen, also für die Krankheitsgestalt beider Krankheiten, zahlreiche Überschneidungen. Entsprechend
dem Prinzip der Differentialdiagnose muss sich das Augenmerk also auf die Faktoren richten, die eine Unterscheidung ermöglichen oder die zumindest auf der Basis der Wahrscheinlichkeit zur
diagnostischen Favorisierung der einen oder der anderen Krankheit beitragen. In einem kleinen Teil der Fälle muss allerdings damit gerechnet werden, dass eine endgültige Differenzierung zwischen
MS und LNB zunächst oder auch auf Dauer nicht überzeugend gelingt.
Die oft schwierige Differenzierung zwischen MS und LNB erfordert einen sehr umsichtigen Umgang mit der Diagnose. Unerlässliche Voraussetzung für die Diagnose einer MS ist der sichere Ausschluss
differentialdiagnostischer Alternativen.
Die voreilige „Etikettierung“ des Patienten mit der vermeintlichen Diagnose MS könnte im weiteren Krankheitsverlauf alternative Überlegungen und damit die Behandlung anderer Krankheiten,
insbesondere der LNB, verhindern (1). In einer Studie wurden 281 Patienten mit vermeintlicher, wahrscheinlicher oder möglicher MS stationär nachuntersucht. Dabei wurde die Diagnose MS nur bei 33%
bestätigt (36).
Auch können differentialtherapeutische Aspekte die Differentialdiagnose MS/LNB eher erschweren; dies trifft auf Immunmodulatoren zu, insbesondere auf Glatiramer, das häufig bei der MS zur
Verzögerung von Schüben eingesetzt wird, das jedoch aufgrund seiner entzündungshemmenden Wirkung durch Stimulation der Th2-Lymphozyten (3) eine günstige Wirkung bei der chronischen LNB entwickeln
könnte. Die Diskussion über den Einsatz solcher Immunmodulatoren bei der LNB steht im Anfang der Problemdiskussion, eindeutige wissenschaftliche Erkenntnisse oder gar Publikationen im
Zusammenhang mit dem klinischen Verlauf liegen nicht vor.
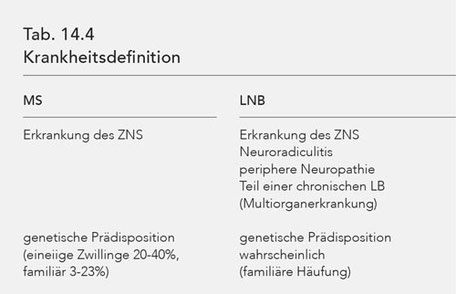
Bei der Differentialdiagnose der MS werden verschiedene Krankheitsgruppen unterschieden: Infektionskrankheiten, entzündliche Erkrankungen, genetische Krankheiten, granulomatöse Krankheiten,
Erkrankung des Myelins und sonstige Krankheitszustände (Tab. 14.1).
Im Vergleich zur LNB sind andere Krankheiten, die differentialdiagnostisch bei der MS in Betracht kommen, aufgrund ihrer charakteristischen Krankheitsgestalt relativ gut abgrenzbar. Die
essentiellen Grundsätze bei der Differentialdiagnose MS/LNB enthält die Tabelle 14.2.

Aufgrund der stark dominierenden Bedeutung beschränkt sich die im Folgenden dargestellte Differentialdiagnose der MS auf die Abgrenzung gegenüber der LNB. Die übrigen in Tabelle 14.1 aufgeführten Krankheiten bleiben unberücksichtigt; auf die entsprechende Literatur sei verwiesen (2). Zunächst wird bei dieser differentialdiagnostischen Unterscheidung die in Schüben und Remissionen verlaufende Form der MS berücksichtigt („Relapsing Remitting Multiple Sklerosis“, RRMS), danach wird die primär progressive Form einbezogen („Primary Progressive Multiple Sklerosis“, PPMS) (vgl. Tabelle 14.3).

Die Krankheitsdefinitionen und die Pathophysiologie im Hinblick auf MS bzw. LNB sind in den Tabellen 14.4 und 14.5 skizziert (37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47).
Die für die Differentialdiagnose MS/LNB relevanten Untersuchungsgebiete und -methoden sind in Tabelle 14.6 zusammengestellt.




Da die Lyme-Borreliose (LB) infolge Verbreitung der Erreger im gesamten Organismus zu einer Multiorganerkrankung führt, stellt die Lyme-Neuroborreliose (LNB) in aller Regel eine Teilmanifestation
der generalisierten Erkrankung dar. Störungen im zentralen Nervensystem sind praktisch immer begleitet von Erkrankungen anderer Organe oder Organsysteme. Die Beachtung dieser anderen
Organmanifestationen ist für die Diagnose der LNB von elementarer Bedeutung. Einschränkungen ergeben sich allerdings in der frühen Phase einer akuten LNB, bei der (praktisch) ausschließlich
Störungen im Nervensystem vorliegen können.
Im Zusammenhang mit der generalisierten Lyme-Borreliose sind die häufigsten Organmanifestationen in Tabelle 14.7 aufgelistet (48, 49).
Die differentialdiagnostischen Faktoren bei LNB bzw. MS hinsichtlich Krankheitsumstände, Symptomatik und Krankheitsverlauf sind in Tabelle 14.8 gegenübergestellt. Dabei werden auch Krankheitsmanifestationen, die für beide Krankheitsbilder besonders charakteristisch sind, mit einbezogen. Die Differenzierung zwischen MS und LNB beruht insbesondere auf den Tatsachen, dass die MS ausschließlich eine Erkrankung des zentralen Nervensystems ist, während die LNB oft mit einer generalisierten akuten oder chronischen Lyme-Borreliose einhergeht, die viele andere Organsysteme (neben dem ZNS) betrifft. Eine Polyneuropathie oder sonstige Erkrankungen des peripheren Nervensystems sind mit einer MS kaum vereinbar, andererseits jedoch eine häufige Manifestation der LNB.

Bei einem Schub der MS zeigt sich oft ein ähnliches Krankheitsbild wie bei dem vorausgehenden Schub. Dies gilt in gleicher Weise für die LNB, so dass sich für die Differentialdiagnose keine
Konsequenzen ergeben.
Zum klinischen Verlauf der MS sind der Vollständigkeit halber folgende Anmerkungen zu machen.
Häufigste Form RRMS, junge Erwachsene, CIS, Opticusneuritis, Symptome und Befunde im Hinblick auf lange Nervenbahnen, Hirnstamm (internukleäre Ophthalmoplegie), Querschnittsmyelitis.
PPMS meistens spastische Paraparese, kein eindeutiges Niveau für Sensibilitätsstörungen.
Schub bei RRMS definiert als akute entzündliche Demyelinisierung im ZNS, kein Fieber, keine Infektion, Schub erreicht seinen Höhepunkt nach Tagen bis einigen Wochen, danach Remission, minimale
Dauer eines Schubs 1 Tag.
Tendenz zur selben Lokalisation bei Schub (z.B. Myelon, Nervus opticus, Hirnstamm).
Ursachen für Verschlimmerung: Fieber, körperliche Aktivität, metabolische Störungen
Internukleäre Ophthalmoplegie:
Horizontaler Nystagmus des abduzierenden Auges, Vorliegen einer (inkompletten) Abducensparese
Schmerzen bei 53% der Patienten:
Trigeminusneuralgie 2%, Lhermitte 9%, Dysästhesie 18%, Rückenschmerzen 16%, Bauchschmerzen 3%, schmerzhafte tonische Spastik 11%, Vertigo 30-50%, Nystagmus 2-4%, Paraparese, Amyotrophie
(Inaktivitätsatrophie), Koordinationsstörungen, Blasen- Darm- und sexuelle Störungen, Hitzeempfindlichkeit (Uhthoff-Phänomen)
Paroxysmale Symptome:
Läsionen im Hirnstamm: Diplopie, partiale Parästhesien, Trigeminusneuropathie, Ataxie, Dysarthrie
Beeinträchtigung des motorischen Systems:
Schmerzhafte tonische Kontraktionen, gutes Ansprechen auf Carbamazepin, Paroxysmale Symptome können nach Wochen oder Monaten rezidivieren ohne erneuten Schub.
Fatigue partiell oder vollständig gebessert durch Ruhe. Fatigue möglicherweise im Zusammenhang mit Schlafunterbrechungen bei MS.
Epilepsie ca. 2-3% der Patienten.
MRT-Läsionen: Periventrikulär, Corpus callosum, Centrum semiovale, weißes Marklager, Basalganglien.
Liquor: Zwei Drittel der Patienten mit MS keine Pleozytose, 5% 15 Zellen oder mehr, Rarität Pleozytose über 50 Zellen. – OB 95%.
Die medizinisch-technischen Untersuchungen zur Differenzierung MS/LNB werden gesondert dargestellt (Tabelle 14.20).
Krankheitsphänomene, die der Diagnose einer MS entgegenstehen, sind in Tabelle 14.9 dargestellt. Dabei handelt es sich im Wesentlichen um eine gleichmäßige Progression, Auftreten der
neurologischen Störung vor dem 10. und nach dem 50. Lebensjahr und Krankheitsphänomene, die dem Cortex zuzuordnen sind (2).
Krankheitsmanifestationen, die bei der LNB nicht aber bei der MS auftreten, enthält die Tabelle 14.10. Die cranielle Neuropathie ist bei der LNB ein häufiges Vorkommnis, nicht jedoch bei der MS,
abgesehen von der bei beiden Krankheiten auftretenden Opticusneuritis. Dabei ist jedoch zu beachten, dass der N. opticus entwicklungsgeschichtlich dem Gehirn zuzuordnen ist, während es sich bei
den übrigen Hirnnerven um periphere Nerven handelt.
Bei der Differentialdiagnose MS/LNB ist zu beachten, dass auch bei der MS einige Krankheitsmanifestationen vorkommen, die bei der LNB als häufige Manifestationen gelten:
- Fatigue
- Mentale Störungen
- Kognitive Störungen
- Epilepsie
- Encephalitis und Meningitis bei PPMS und SPMS
- Kortikale Demyelinisierungen meistens bei PPMS und SPMS
Selten wird auch bei MS eine Polyneuropathie beobachtet. Wegen der Seltenheit des Vorkommnisses wird eine zufällige Koinzidenz angenommen. Generell sollte eine Polyneuropathie bei dem vermeintlichen Krankheitsbild einer MS den Blick auf die Differentialdiagnose schärfen, insbesondere auch auf eine Lyme-Neuroborreliose (1).
Bei einigen Patienten zeigen sich bei der MS Prodromi (1), die den Symptomen einer Lyme-Borreliose weitgehend entsprechen: Fatigue, Gewichtsverlust, Muskelskelettbeschwerden (Tabelle 14.11).
Auch die Häufigkeit von MS-Symptomen (4, 50, 51), deren Entwicklungsgeschwindigkeit (52) sowie die Dauer von Schüben und Remissionen (4) tragen zur Differentialdiagnose MS/LNB bei (Tabelle 14.12-14.14).


Im Gegensatz zur MS ist die Entwicklungsgeschwindigkeit der chronischen LNB wesentlich langsamer und erstreckt sich über Wochen bis Monate. Dagegen entwickelt sich die akute LNB, ähnlich wie bei den meisten Fällen der MS, innerhalb von Tagen. Allerdings ist die akute LNB aufgrund der akuten schweren allgemeinen Krankheitssymptomatik und des Liquorbefundes (insbesondere Pleozytose infolge Meningitis) von einem Schub bei MS gut abgrenzbar (Tabelle 14.15).
Eine isolierte Opticusneuritis ohne sonstige Krankheitssymptome, meistens unilateral, gilt als häufige Erstmanifestation einer MS. Werden bei einer solchen Opticusneuritis im MRT cerebrale Läsionen nachgewiesen, entwickelt sich (bei einem Beobachtungszeitraum von 10 Jahren) in 56% der Fälle nachfolgend das typische Krankheitsbild einer MS, bei Fehlen von Läsionen (zum Zeitpunkt der Opticusneuritis) nur in 22% (Tab. 14.16) (54).






Unter einem CIS („Clinical Isolated Syndrome“) wird eine einzelne Attacke verstanden, die mit einem Schub einer MS vereinbar ist, z.B. eine Opticusneuritis oder eine sonstige neurologische Manifestation im ZNS. Diese zunächst vermeintlich singuläre Attacke ist im weiteren Krankheitsverlauf in 80% der Fälle von der Entwicklung einer MS gefolgt. Auch in dieser Situation zeigt sich wieder eine Häufigkeitsabhängigkeit von Läsionen im cerebralen MRT. Bei Auftreten eines CIS mit cerebralen Läsionen ist prognostisch mit der Entwicklung einer MS zu rechnen und zwar in 80% der Fälle (55). Nur 20% (CIS, cerebrale MRT-Läsionen) entsprechen einem selbstlimitierenden Prozess. Da eine möglichst frühe modifizierende Behandlung den weiteren Krankheitsverlauf günstig beeinflusst, wird das Auftreten eines CIS zusammen mit Läsionen im cMRT als Grund für eine frühzeitige Therapie angesehen (57) (Tabelle 14.17).
Unter RIS (Radiologisch Isoliertes Syndrom) werden zufällig festgestellte MRT-Veränderungen vereinbar mit MS ohne klinische Symptomatik eingeordnet. Eine therapeutische Konsequenz ergibt sich
nicht. Eine Unterscheidung zwischen MS und LNB anhand des MRT ist grundsätzlich nicht möglich (Tabelle 14.17).
Angaben zur Progredienz der MS-Symptomatik weisen in der Literatur erhebliche Unterschiede auf. In der Studie von Tremlett et al., 2006 (58) ergab sich ein Behinderungsgrad („Expanded Disability
Status Scale“, EDSS) von 6, d.h. die Benötigung einer Gehhilfe im Durchschnitt 16 Jahre nach Krankheitsbeginn (Tabelle 14.18).
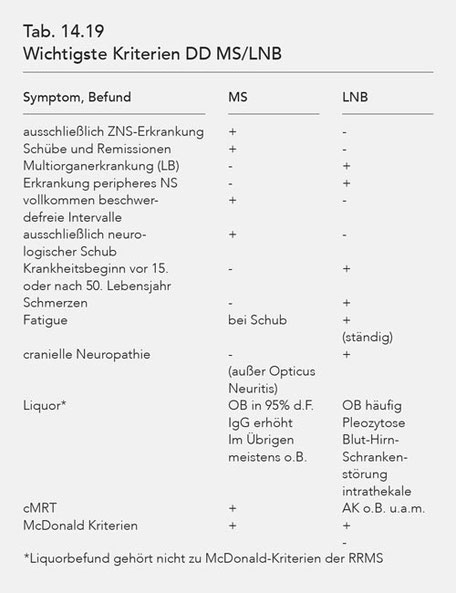
Die wichtigsten Kriterien bei der Differentialdiagnose MS/LNB enthält die Tabelle 14.19. Besonders herauszustellen ist die Tatsache, dass die MS praktisch ausschließlich das ZNS betrifft, meist
in klar differenzierbaren Schüben und Remissionen (mit völliger oder weitgehender Beschwerdefreiheit) verläuft und der Liquorbefund bei der Differenzierung hilfreich ist. Die McDonald-Kriterien
(s.u.), die nach internationalem Konsens für die Diagnose einer MS gültig sind, enthalten in ihrer Neufassung 2010 nicht mehr den Liquorbefund. Die Beachtung des Liquors ist jedoch im Hinblick
auf die LNB als wichtige Differentialdiagnose MS von erheblicher Bedeutung und somit auch für die Differentialdiagnose MS/LNB. Dieser Aspekt blieb bei der Neufassung der McDonald-Kriterien
unberücksichtigt (Tabelle 14.19).
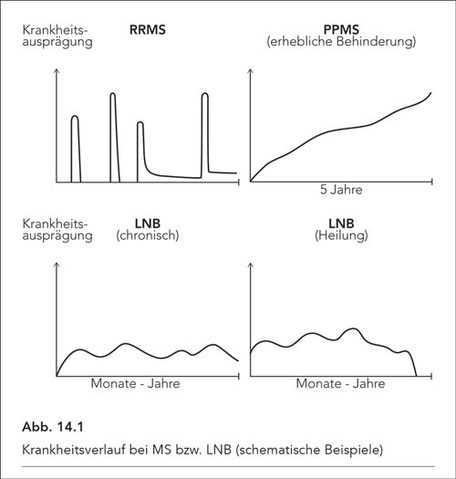
Auch der Krankheitsverlauf trägt zur Unterscheidung MS vs. LNB wesentlich bei. Während die MS (RRMS) in Schüben und beschwerdefreien bzw. residualarmen Phasen verläuft, die Primär Progressive MS (PPMS) eine stetige Progredienz aufweist, zeigt die chronische LNB einen mehr fluktuierenden Verlauf. Die Unterschiede sind schematisch in Abb. 14.1 dargestellt.
Medizinisch-technische Befunde, die bei der Differentialdiagnose MS/LNB von Bedeutung sind, enthält die Tabelle 14.20. Dem MRT und der Liquordiagnostik wird bei der MS besondere Bedeutung
zugemessen. Bei der Abgrenzung gegenüber der LNB unterliegen jedoch beide Methoden erheblichen Einschränkungen. Die für die MS vermeintlich typischen Läsionen sind in gleicher Weise häufig bei
der LNB vorhanden und tragen somit zur Differentialdiagnose nicht bei (19, 21, 22). Auch ausgedehnte Demyelinisierungsherde sind keinesfalls für die MS spezifisch, sondern sind auch bei der LNB
beschrieben (1, 14, 15, 18, 20, 23). Die Liquordiagnostik gehört nach Revision 2010 nicht mehr zu den McDonald Kriterien, trotz der erheblichen Bedeutung für die Differentialdiagnose
MS/LNB.
Bei der Liquordiagnostik wird im Zusammenhang mit der MS dem Nachweis oligoklonaler Banden (OB) hohe Bedeutung beigemessen, da sie in 90-95% der Fälle nachweisbar sind. OB sind jedoch
unspezifisch und treten bei zahlreichen entzündlichen Erkrankungen des ZNS auf (10, 11, 12, 13); dies gilt in hohem Maße auch für die LNB (29). Im Übrigen ist der Liquor bei der MS nicht oder nur
geringfügig verändert, abgesehen von einer häufig vorkommenden Erhöhung des IgG (intrathekal). Jedoch trägt ein solcher Befund nicht zur Differenzierung gegenüber der LNB bei. Bei der akuten LNB
und bei einem Schub einer chronischen LNB ist dagegen der Liquor meistens deutlich pathologisch verändert (Pleozytose, Störung der Blut-Hirn-Schranke). Zudem lassen sich zahlreiche für die LNB
typische Liquorveränderungen nachweisen: Borrelien-spezifische Antikörper, erhöhter Antikörperindex, Unterschiede im Westernblot (Liquor/Serum), Bb-spezifische oligoklonale Banden, OspA, CXCL13,
und ggf. Erregernachweis (29).




Im Hinblick auf die Bildung von Bb-Antikörper im zentralen Nervensystem (intrathekale oder autochthone Antikörperbildung) sind 2 Aspekte von besonderer Bedeutung:
- Bei chronischer LNB können intrathekale AK fehlen
- Bei akuter LNB entwickeln sich intrathekale AK mit deutlicher zeitlicher Verzögerung nach Auftreten der akuten neurologischen Symptomatik (vgl. Abb. 14.2)
Aus diesen Gründen wird die chronische LNB wegen fehlender AK oft fälschlicherweise negiert und die akute LNB wegen noch nicht nachweisbarer intrathekaler Antikörper zu spät diagnostiziert, mit der Folge einer verspäteten notwendigen antibiotischen Behandlung.
Bei der akuten Lyme-Neuroborreliose (LNB) in der Frühphase liegt meistens überhaupt noch kein pathologischer Liquorbefund vor, also auch keine unspezifischen Veränderungen (Pleozytose, Blut-Hirn-Schrankenstörung), so dass sich die Diagnose nicht auf den Liquorbefund stützen kann. In einer Studie waren bei 799 Patienten mit eindeutig akuter LNB nur in 42 Fällen, d.h. in 5,25% Liquorveränderungen entsprechend den Kriterien der Leitlinien der Fachgesellschaften vorhanden (Epidemiologisches Bulletin des Robert-Koch-Instituts, Berlin, 38/2007). In diesem Bulletin heißt es: „Der in der zur Zeit gültigen Form der Falldefinition geforderte labordiagnostische Nachweis der frühen Neuroborreliose wird nur bei einem sehr kleinen Anteil der übermittelten Neuroborreliosefälle erfüllt, eine Problematik, auf die schon in einem früheren Bericht hingewiesen wurde“.
Diese relativ seltene und geringe immunologische Antwort (Entzündung) führte zu der Annahme, dass ein direkter erregerabhängiger Pathomechanismus der Lyme-Neuroborreliose denkbar ist (Oschmann et al. (30)).
Bei der chronischen Lyme-Neuroborreliose weist der Liquor oft keine Pleozytose auf, da sich bei den chronischen Verläufen im Gegensatz zu der akuten Lyme-Neuroborreliose die entzündlichen
Prozesse in der Tiefe des ZNS abspielen, also nicht an die oberflächennahen Strukturen, insbesondere die Meningen, heranreichen und somit die wesentliche Voraussetzung für eine Pleozytose
entfällt.
Elektrophysiologische Untersuchungen dienen bei der MS ausschließlich dem Nachweis zentralnervöser Störungen, da periphere Störungen (Polyneuropathie) bei der MS (praktisch) nicht vorkommen.
Dagegen ist die Polyneuropathie, also eine Beeinträchtigung peripherer neurologischer Systeme bei der LNB ein häufiges Vorkommnis. Betrifft die LNB auch das zentrale Nervensystem, wird dies bei
den evozierten Potentialen (EPs) sichtbar. Zur Differentialdiagnose MS/LNB trägt also ausschließlich der Nachweis peripherer neurologischer Störungen (Polyneuropathie, Neuroradiculitis) bei.
Zwecks besserer Übersicht sind die pathologischen Liquorbefunde bei der LNB in Tabelle 14.21 gesondert dargestellt. Der Nachweis von intrathekalen Antikörper gegen Borrelien ist für die LNB
beweisend, wenn ein entsprechendes klinisches Krankheitsbild mit entzündlichem Liquor vorliegt. Diese intrathekale Antikörpersynthese tritt jedoch zeitverzögert, d.h. etwa 2 Wochen nach Auftreten
der neurologischen Symptome auf und ist zeitabhängig in nur 50 bis 80% der Fälle nachweisbar (17), Abb. 14.2.
Seronegativität (im Serum) schließt eine LNB keinesfalls aus. Es liegen mehrere Studien vor, bei denen die LNB durch Erregernachweis gesichert wurde, im Blut aber Seronegativität vorlag (vgl.
Tabelle 14.22).
Der Liquorbefund bei MS zeigt häufig oligoklonale Banden aufgrund intrathekaler Synthese und gelegentlich eine geringe Pleozytose; die Konzentration für Protein und Albumin ist in der Regel
normal (Tabelle 14.23) (1). Nach Erfahrung des Verfassers kann bei sehr seltenen Fällen die Pleozytose bis zu 100 Zellen/µl betragen (unveröffentlicht). Bei den aktuellen McDonald Kriterien in
der Revision von 2010 (59) ist der Liquorbefund bei der RRMS nicht mehr einbezogen.
Bei Betrachtung des Krankheitsverlaufes bei LNB bzw. MS (vgl. Abb. 14.1) besteht vergröbernd der Eindruck, dass die MS junge, zuvor völlig gesunde Menschen betrifft. Allerdings sind bei einigen
Patienten auch Prodromi vorhanden in Form von Fatigue (allgemeine Erschöpfung, Krankheitsgefühl), Gewichtsverlust, Muskel- und Gelenkschmerzen. Diese Prodromi ähneln Symptomen einer
generalisierten Lyme-Borreliose und gehen über Wochen oder Monate den neurologischen Symptomen voraus (7). Bei der chronischen LNB besteht im Gegensatz zur MS ein sich über lange Zeit
hinziehender Krankheitsprozess (Monate bis Jahre), bei dem die neurologischen Manifestationen in ihrer Ausprägung variieren. In Schüben kommt es zu einer Verschlimmerung der LNB, zwischenzeitlich
bestehen beschwerdeärmere Intervalle, jedoch persistieren auch während dieser Intervalle im Gegensatz zur MS neurologische Defizite in mehr oder weniger ausgeprägter Form. Nicht selten zeigt sich
jedoch bei der LNB (insbesondere auch nach antibiotischer Behandlung) selbst nach Jahren eine allmähliche Besserung mit einem für den Patienten erträglichen Ausgang. Pauschal betrachtet hat also
die MS einen mehr episodischen, die LNB mehr einen chronisch fluktuierenden Krankheitsverlauf. Die chronische LNB ist in der Regel eine langsam progrediente Erkrankung (9) (Abb. 14.1).
Nach einer Reihe von Jahren besteht bei der MS die Tendenz, in eine langsam stetig progrediente Phase überzugehen. Ein solcher Verlauf kann auch in 10% der Fälle bereits mit Krankheitsbeginn
auftreten; diese Verläufe werden als primär progressive Multiple Sklerose bezeichnet (8).



Bei ausschließlicher Betrachtung der neurologischen Manifestationen sind solch chronische Verlaufsformen von der chronischen LNB nur schwer zu unterscheiden. Allerdings ist durch Einbeziehung anderer diagnostischer Faktoren (vgl. Tabelle 14.8 und 14.19) eine Differenzierung möglich.
Die Primär Progressive Multiple Sklerose (PPMS) verläuft meistens in Form einer chronisch asymmetrischen spastischen Paraparese. Die MRT-Befunde zeigen meistens keine Progression. Das Ansprechen
auf die Therapie ist gering und die Prognose ungünstig.
Skepsis in Bezug auf eine MS sollte bei folgenden Faktoren bestehen: Fehlen von Symptomen einer Opticusneuritis, Vorliegen einer Amyotrophie, völlig normale Augenbewegung, Gesichtsfeldausfälle im
Sinne einer Hemianopsie, Schmerzen als dominierendes Symptom und ein mit der Jugend beginnender Krankheitsverlauf ohne Remissionen.
In der Frühphase der MS sind einige, jedoch seltene Symptome beschrieben worden: Ermüdungsschwäche beim Spazierengehen, Hirnstammsymptome (Doppelbilder, Übelkeit, Erbrechen), Taubheit und
Parästhesie einer gesamten Extremität, Gesichtsschmerzen, Blasenentleerungsstörungen. Noch seltener sind Hemiplegien, Trigeminusneuralgie oder Schmerzsyndrome, Facialisparese, Taubheit oder
cerebrale Anfälle.
Nicht ganz so selten ist die MS gekennzeichnet durch Nystagmus und Ataxie mit oder ohne Parese oder Spastik der betroffenen Extremität. Auch eine sakkadierte Sprache, eine rhythmische
Instabilität von Kopf und Rumpf, Intentionstremor der Extremitäten und Koordinationsstörung des Ganges können Manifestationen der MS darstellen. – Die als Charcot’sche Trias (Nystagmus, Sakkade,
Intentionstremor) bezeichnete Symptomatik stellt eine Krankheitsmanifestation des weit fortgeschrittenen Stadiums der MS dar (1).
Die Diagnose einer MS erfordert nach derzeit gültigem internationalem Konsens das Vorliegen der McDonald-Kriterien in der Revision von 2010 (59). Sie stützen sich im Wesentlichen auf die klinischen Manifestationen, das MRT und zusätzliche Voraussetzungen. Der Liquorbefund gehört praktisch nicht mehr zu den McDonald-Kriterien, nur als zusätzliche Voraussetzung bei der PPMS wird der Nachweis von oligoklonalen Banden oder einem erhöhten IgG-Index einbezogen. Zudem heißt es bei den McDonald-Kriterien: Bei unauffälligem MRT oder Liquor ist eine alternative Diagnose in Betracht zu ziehen. Die Definition eines MS-Schubes lautet: Akutes entzündliches demyelinisierendes Ereignis im ZNS (aktuell oder anamnestisch), Dauer mindestens 1 Tag, Fehlen von Fieber und Infektionen sowie mindestens 2 Episoden einer MS-Symptomatik mit einer Mindestdauer von jeweils 1 Tag. Die McDonald-Kriterien beinhalten im Wesentlichen Dissemination „in space“ (Zunahme der Lokalisationen von Veränderungen im ZNS), Dissemination in time (Zunahme der ZNS-Läsionen im Krankheitsverlauf) sowie zusätzliche Voraussetzungen (Tab. 14.24). Dabei stützt sich die Dissemination „in space and time“ auf klinische Befunde und/oder den MRT-Befund. Die Einzelheiten sind in Tabelle 14.25 und 14.26 dargestellt.
Im Hinblick auf die Dissemination „in space“ fordern die McDonald-Kriterien eine zweite klinische Attacke mit einer anderen anatomischen Zuordnung als beim ersten Schub, d.h. ein Schub der
klinisch oder im MRT mit dem vorausgehenden Schub identisch ist, erfüllt nicht ein obligates Kriterium der McDonald-Kriterien, so dass die Voraussetzungen für die Diagnose einer MS fehlen würden.
Diese Regelung wirft Probleme auf, da ein MS-Schub nicht selten klinisch und radiologisch dem vorausgehenden Schub weitgehend ähneln kann. Entsprechend heißt es bei den zusätzlichen
Voraussetzungen der McDonald-Kriterien: Bei 2 Schüben, die nur einer Läsion zugeordnet werden können, muss für MS Dissemination „in space“ nachgewiesen werden. Das MRT muss also im Vergleich zu
dem Vorbefund eine Zunahme und/oder räumliche Ausdehnung der Läsionen zeigen.
Im Übrigen sei darauf hingewiesen, dass die Kriterien nach Dissemination „in space“ alle erfüllt sein müssen, während bei den
Kriterien nach Dissemination „in time“ nur ein Kriterium gefordert wird.
Zu den McDonald-Kriterien gehört auch die Definition eines MS-Schubs und die Benennung der Kriterien im Hinblick auf die diagnostische Evidenz (Tabelle 14.28, 14.29).
Auch die diagnostische Evidenz (MS) ist in den McDonald-Kriterien geregelt: Die Diagnose einer MS ist gesichert, wenn alle obligaten Kriterien erfüllt sind und keine bessere Erklärung durch eine
andere Krankheit in Betracht kommt.
Nach gültigem internationalem Konsens darf also die Diagnose einer MS nur gestellt werden, wenn die McDonald-Kriterien erfüllt sind. Diese Forderungen hat besondere Bedeutung in der Phase der
Erstmanifestation einer vermeintlichen oder vermuteten MS. Bei nur einem Schub ist stets die Dissemination „in time“ nachzuweisen, d.h. eine vorausgehende neurologische Störung vereinbar mit MS
muss sich aus der anamnestischen Befragung oder durch den Vergleich mit einem früheren MRT ergeben.
Die Erfüllung der McDonald-Kriterien ist die Voraussetzung, nicht jedoch der Beweis für die Diagnose einer MS. Insofern ist die Verwendung des Begriffes „gesichert“ in den McDonald-Kriterien zu
hinterfragen. Allerdings gilt die Diagnose nach der diagnostischen Evidenz entsprechend den McDonald-Kriterien nur dann als gesichert, wenn keine bessere Erklärung durch andere Krankheiten
gegeben ist (vergl. Tab. 14.29). Mit anderen Worten: Sind bei einer Erkrankung des zentralen Nervensystems die McDonald-Kriterien erfüllt, muss dennoch die Lyme-Neuroborreliose (LNB)
differentialdiagnostisch berücksichtigt werden. Eine solche Differentialdiagnose (MS/LNB) kann sich nicht auf die McDonald-Kriterien stützen, da die Einzelkriterien, nämlich neurologisches
Defizit und MRT-Befund eine Unterscheidung zwischen MS und LNB nicht ermöglichen.
Dieser Umstand spiegelt sich in den McDonald-Kriterien in der Revision 2010 wider: Im Kapitel „Zusätzliche Voraussetzungen“ wird gefordert, dass eine MS nur diagnostiziert werden darf, wenn das klinische Bild und die Befunde nicht durch ein anderes Krankheitsbild besser erklärt werden können (Tab. 14.27).
Aktuelle Kritik im Zusammenhang mit der vorliegenden Problematik betreffen im Wesentlichen 2 Punkte:
- Die MS wird fälschlicherweise zu häufig diagnostiziert (36)
- Der Liquorbefund spielt bei den McDonald-Kriterien Revision 2010 keine wesentliche Rolle mehr, obwohl er im Hinblick auf die Differentialdiagnose MS/LNB von erheblicher Bedeutung sein kann.
Das International Advisory Committee on Clinical Trials of MS hat 2013 in einer Revision den klinischen Verlauf der MS definiert unter besonderer Berücksichtigung der Krankheitsaktivität. Die
entsprechende Definition verschiedener Phänotypen der MS sind in Tabelle 14.30 dargestellt (75).
Auch die Effizienz einer eingesetzten Therapie kann zur Differenzierung zwischen MS und LNB beitragen. Da die LNB eine bakterielle Infektionskrankheit ist, die MS jedoch (hypothetisch) als
Autoimmunerkrankung aufgefasst wird, ergeben sich konträre Therapieansätze (Tab. 14.31). Eine Glucocorticoid-Hochdosistherapie hat bei einer fälschlich angenommenen MS und tatsächlich
vorliegenden LNB keinen therapeutischen Effekt, vielmehr kommt es häufig unter der Glucocorticoid-Behandlung zu einer Verschlechterung der Beschwerdesymptomatik. Ursache ist die Unterdrückung des
Immunsystems und die hieraus resultierende Begünstigung der Infektion. Im Übrigen sei angemerkt, dass Corticoide ausschließlich beim Schub einer RRMS indiziert sind. Die modifizierende Behandlung
mit Glatiramer oder Interferon dient der Schubprophylaxe, d.h. zur Vergrößerung der Abstände zwischen den Schüben bei RRMS. Bei einer primär chronischen Verlaufsform sind Glucocorticoide und
modifizierende Medikamente kontraindiziert.
In engem Zusammenhang mit der Multiplen Sklerose werden folgende neurologische Krankheitsbilder in der Literatur diskutiert:








langsam progrediente primäre Myelopathie bei MS, akute (subakute) nekrotisierende Myelitis (Neuromyelitits optica) (NMO, Devic Krankheit), die akute disseminierte Encephalomyelitis (ADEM) und das
CIS („Clinical Isolated Syndrome“). Diese Krankheitsbilder werden in den folgenden Kapiteln einzeln dargestellt.
Bei der immunmodulatorischen Behandlung der RRMS ist zu beachten, dass die Stufen 4, 6 und 7 auf der Behinderungsskala erst nach 11, 23 bzw. 33 Jahren erreicht werden. Das heißt, selbst nach über
20 Jahren liegt im Durchschnitt keine hochgradige Behinderung vor. Überdies hat die Anzahl der Schübe keinen signifikanten Einfluss auf die Progression einer irreversiblen Behinderung (73). Diese
Daten wurden in einer neueren Studie bestätigt (74).
- Literaturverzeichnis
-
- Victor M und Ropper AH. Principles of Neurology. McGraw-Hill. 2001.
- Olek MJ. Diagnosis of multiple sclerosis in adults. UpToDate. 2008.
- Olek MJ. Treatment of relapsing-remitting multiple sclerosis in adults. UpToDate. 2012.
- Olek MJ. Epidemiology, risk factors, and clinical features of multiple sclerosis in adults. UpToDate. 2008.
- Rupprecht TA, Kirschning, CJ, Popp B, Kastenbauer S, Fingerle V, Pfister HW, Koedel U. Borrelia garinii induces CXCL13 production in human monocytes through Toll-like receptor 2. Infect Immun. 2007; 75(9):4351-6.
- Coyle PD, Schutzer SE, Deng Z, Krupp LB, Belman AL, Benach JL, Luft BJ. Detection of Borrelia burgdorferi-specific antigen in antibody-negative cerebrospinal fluid in neurologic Lyme disease. Neurology. 1995; 45(11):2010-5.
- McAlpine D, Lumsden CE, Acheson ED. Multiple Sclerosis: A Reappraisal, 2nd ed. Edinburgh, Churchill Livingstone. 1972.
- Thompson AJ, Polman CH, Miller DH, McDonald WI, Brochet B, Filippi M Montalban X, De Sá J. Primary progressive multiple sclerosis. Brain. 1997; 120:1085.
- Pfister HW, Rupprecht T, Wilske B, Fingerle V. Zellzahl im Liquor soll nach 6 Monaten normal sein. CME, 1/07, TMP, 31.
- Bourahoui A, De Seze J, Guttierez R, Onraed B, Hennache B, Ferriby D, Stojkovic T, Vermersch P. CSF isoelectrofocusing in a large cohot of MS and other neurological diseases. Eur J Neurol. 2004; 11(8):525-9.
- Kristoferitsch W, Lanschützer H, Oligoclonal. Immunoglobulin M in the cerebrospinal fluid of patients with Garin-Bujadoux-Bannwarth meningopolyneuritis. Wien Klin Wochenschr. 1986; 98(12):386-8.
- Martin R, Martens U, Sticht-Groh V, Dörries R, Krüger H. Persistent intrathecal secretion of oligoclonal, Borrelia burgdorferi-specific IgG in chronic meningoradiculomyelitis. J Neurol. 1988; 235(4):229-33.
- Maravi Petri E, Oteo Revuelta JA, Pérez Gómez JM, De Miguel Medina C, López Unzu A. Lymphocytic meningoradiculitis (Bannwarth’s syndrome). Neurologic involvement of Lyme disease. Rev Med Univ Navarra. 1989; 33(1):19-22.
- Oksi J, Kalimo H, Marttila RJ, Marjamäki M, Sonninen P, Nikoskelainen J, Viljanen MK. Inflammatory brain changes in Lyme borreliosis. A report on three patients and review of literature. Brain. 1996; 119(6):2143-54.
- Reik L Jr, Smith L, Khan A, Nelson W. Demyelinating encephalopathy in Lyme disease. Neurology. 1985; 35(2):267-9.
- Pavlovic D, Lević Z, Dmitrović R, Ocić G. Chronic encephalomyelitis caused by Borrelia burgdoferi. Case report. Glas Srp Akad Nauka (Med). 1993; (43):225-8.
- Coyle PK, Deng Z, Schutzer SE, Belman AL, Benach J, Krupp LB, Luft B. Detection of Borrelia burgdorferi antigens in cerebrospinal fluid. Neurology. 1993; 43(5):1093-8.
- Bertrand E, Szpak GM, Piłkowska E, Habib N, Lipczyńska-Lojkowska W, Rudnicka A, Tylewska-Wierzbanowska S, Kulczycki J. Central nervous system infection caused by Borrelia burgdorferi. Clinico-pathological correlation of three post-mortem cases. Folia Neuropathol. 1999; 37(1):43-51.
- Triulzi F und Scotti G. Differential diagnosis of multiple sclerosis: contribution of magnetic resonance techniques. J Neurol Nerosug Psychiatry. 1998; 64(1):6-14.
- Pincemaille O, Pin I, Wroblewski I, François P, Gratacap B, Joannard A, Bost M. Meningo-encephalomyelitis in Lyme disease. Arch Fr Pediatr. 1989; 46(8):589-90.
- Tarasow E, Ustymowicz A, Zajkowska J, Hermanowska-Szpakowicz T. Neuroborreliosis: CT and MRI findings in 14 cases. Preliminary communication. Neurol Neurochir Pol. 2006; 35(5):803-13.
- Agosta F, Rocca MA, Benedetti B, Capra R, Cordioli C, Filippi M. MR Imaging assessment of brain and cervical cord damage in patients with neuroborreliosis. AJNR Am J Neuroradiol. 2006; 27(4):892-4.
- Kobayashi K, Mizukoshi C, Aoki T, Muramori F, Hayashi M, Miyazu K, Koshino Y, Ohta M, Nakanishi I, Yamaguchi N. Borrelia burgdorferi-seropositive chronic encephalomyelopathy: Lyme neuroborreliosis? An autopsied report. Dement Geriatr Cogn Disord. 1997; 8(6):384-90.
- Eldeon G, Vik IS, Vik E, Midgard R. Lyme neuroborreliosis in More and Romsdal. Tidsskrift for Den Norske Laegeforening. 2001; 121(17):2008-11.
- Wilske M, Eiffert H, Christen HJ, Hanefeld F. Primarily chronic and cerebrovascular course of Lyme neuroborreliosis: case reports and literature review. Arch Dis Child. 2000; 83(1):67-71.
- Bertrand E, Szpak GM, Piłkowska E, Habib N, Lipczyńska-Lojkowska W, Rudnicka A, Tylewska-Wierzbanowska S, Kulczycki J. Central nervous system infection caused by Borrelia burgdorferi. Clinico-pathological correlation of three post-mortem cases. Folia Neuropathol. 1999; 37(1):43-51.
- Keller TL, Halperin JJ, Whitman M. PCR detection of Borrelia burgdorferi DNA in cerebrospinal fluid of Lyme neuroborreliosis patients. Neurology. 1992; 42(1):32-42.
- Keller TL, Halperin JJ, Whitman M. PCR detection of Borrelia burgdorferi DNA in cerebrospinal fluid of Lyme neuroborreliosis patients. Neurology 1992; 42(1):32-42.
- Berghoff W. Liquordiagnostik bei Lyme-Neuroborreliose und chronischer Lyme-Borreliose mit Encephalopathie. www.praxis-berghoff.de.
- Oschmann P, Wellensiek HJ, Zhong W, Dorndorf W, Pflughaupt KW. Relationship between the Borrelia burgdorferi specific immune response and different stages and syndromes in neuroborreliosis. Infection. 1997; 25(5):292-7.
- Compston A und Coles A. Multiple sclerosis. Lancet. 2008; 372:1502.
- Weiner HL. Multiple sclerosis is an inflammatory T-cell-mediated autoimmune disease. Arch Neurol. 2004; 61:1613.
- Ackermann R. Rehse-Küpper B, Gollmer E, Schmidt R. Chronic neurologic manifestations of Erythema migrans borreliosis. Ann N Y Acad Sci. 1988; 539:16.
- Halperin JJ, Volkmann DJ, Wu P. Central nervous system abnormalities in Lyme neuroborreliosis. Neurology. 1991; 41:1571.
- Logigian EL, Kaplan RF, Steere AC. Chronic neurologic manifestations of Lyme disease. N Engl J Med. 1990; 323:1438.
- Carmosino MJ, Brousseau KM, Arciniegas DB, Corboy JR. Initial evaluations for multiple sclerosis in a university multiple sclerosis center: outcomes and role of magnetic resonance imaging in referral. Arch Neurol. 2005; 62:585.
- International Multiple Sclerosis Genetics Consortium, Hafler DA, Compston A, Sawcer S, Lander ES, Daly MJ, De Jager PL, de Bakker PI, Gabriel SB, Mirel DB, Ivinson AJ, Pericak-Vance MA, Gregory SG, Rioux JD, McCauley JL, Haines JL, Barcellos LF, Cree B, Oksenberg JR, Hauser SL. Risk alleles for multiple sclerosis identified by a genomewide study. N Engl J Med. 2007; 357:851.
- International Multiple Sclerosis Genetics Consortium, Wellcome Trust Case Control Consortium 2, Sawcer S, et al. Genetic risk and a primary role for cell-mediated immune mechanisms in multiple sclerosis. Nature. 2011; 476:214.
- Frohman EM, Racke MK, Raine CS. Multiple sclerosis- -the plaque and its pathogenesis. N Engl J Med. 2006; 354:942.
- Ebers GC. Environmental factors and multiple sclerosis. Lancet Neurol. 2008; 7:268.
- Lincoln MR, Montpetit A, Cader MZ, Saarela J, Dyment DA, Tiislar M, Ferretti V, Tienari PJ, Sadovnick AD, Peltonen L, Ebers GC, Hudson TJ. A predominant role for the HLA class II region in the association of the MHC region with multiple sclerosis. Nat Genet. 2005; 37:1108.
- Gregory SG, Schmidt S, Seth P, Oksenberg JR, Hart J, Prokop A, Caillier SJ, Ban M, Goris A, Barcellos LF, Lincoln R, McCauley JL, Sawcer SJ, Compston DA, Dubois B, Hauser SL, Garcia-Blanco MA, Pericak-Vance MA, Haines JL. Multiple Sclerosis Genetics Group. Interleukin 7 receptor alpha chain (IL7R) shows allelic and functional association with multiple sclerosis. Nat Genet. 2007; 39:1083.
- Lundmark F, Duvefelt K, Iacobaeus E, Kockum I, Wallström E, Khademi M, Oturai A, Ryder LP, Saarela J, Harbo HF, Celius EG, Salter H, Olsson T, Hillert J. Variation in interleukin 7 receptor alpha chain (IL7R) influences risk of multiple sclerosis. Nat Genet. 2007; 39:1108.
- Sadovnick AD, Armstrong H, Rice GP, Bulman D, Hashimoto L, Paty DW, Hashimoto SA, Warren S, Hader W, Murray TJ, et al. A population-based study of multiple sclerosis in twins: update. Ann Neurol. 1993; 33:281.
- Ackermann R, Golmer E, Rehse-Küpper B. Progressive Borrelien-Enzephalomyelitis. Dtsch Med Wschr 1985; 100:1039-1042.
- Ackermann, Rehse-Küpper B, Gollmer E. Progressive Borrelia Enzephalomyelitis. Zentralbl Bakt Hyg. 1986; A263:297-300.
- Ackermann R, Rehse-Küpper B, Gollmer E, Schmidt R. Chronic neurologic manifestations of Erythema migrans borreliosis. Ann NY Acad Sci. 1988; 539: 16-23.
- Berghoff W. Diagnostik und Therapie der Lyme-Borreliose.
www.praxis-berghoff.de. - Berghoff W. Klinische Symptomatik der Lyme-Borreliose (LB) und der Lyme-Neuroborreliose (LNB). umwelt-medizin-gesellschaft. 2/2009.
- Paty D, Studney D, Redekop K, Lublin F. Presenting symptoms in multiple sclerosis. Ann Neurol. 1994; 36:123.
- Studyney D, Lublin F, Marcucci L et al. Presenting symptoms in multiple sclerosis. J Neurol Rehab. 1993; 7:145.
- McAlpine D, Lumsden CE, Acheson ED. Multiple Sclerosis: A Reappraisal. 2nd ed. Edinburgh. Churchill Livingstone.1972.
- Bejaoul K und Rolak LA. What is the risk of permanent disability from a multiple sclerosis relapse? Neurology. 2010; 74:900.
- Beck RW, Trobe JD, Moke PS, Gal RL, Xing D, Bhatti MT, Brodsky MC, Buckley EG, Chrousos GA, Corbett J, Eggenberger E, Goodwin JA, Katz B, Kaufman DI, Keltner JL, Kupersmith MJ, Miller NR, Nazarian S, Orengo-Nania S, Savino PJ, Shults WT, Smith CH, Wall M; Optic Neuritis Study Group. High- and low-risk profiles for the development of multiple sclerosis within 10 years after optic neuritis: experience of the optic neuritis treatment trial. Arch Ophthalmol. 2003; 121:944,
- Brex PA, Ciccarelli O, O‘Riordan JI, Sailer M, Thompson AJ, Miller DH. A longitudinal study of abnormalities on MRI and disability from multiple sclerosis. N Engl J Med. 2002; 346:158.
- Frohman EM, Goodin DS, Calabresi PA, Corboy JR, Coyle PK, Filippi M, Frank JA, Galetta SL, Grossman RI, Hawker K, Kachuck NJ, Levin MC, Phillips JT, Racke MK, Rivera VM, Stuart WH; Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. The utility of MRI in suspected MS: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology. 2003; 61:602.
- Olek MJ. Clinical isolated syndromes suggestive of multiple sclerosis. UpToDate. 2011.
- Tremlett H, Paty D, Devonshire V. Disability progression in multiple sclerosis is slower than previously reported. Neurology. 2006; 66:172.
- Polman CH, Reingold SC, Banwell B, Clanet M, Cohen JA, Filippi M, Fujihara K, Havrdova E, Hutchinson M, Kappos L, Lublin FD, Montalban X, O‘Connor P, Sandberg-Wollheim M, Thompson AJ, Waubant E, Weinshenker B, Wolinsky JS. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol. 2011; 69:292.
- Kidd D, Thorpe JW, Kendall BE, Barker GJ, Miller DH, McDonald WI, Thompson AJ. MRI dynamics of brain and spinal cord in progressive multiple sclerosis. J Neurol Neurosurg Psychiatry. 1996; 60:15.
- Lotze TE. Differential diagnosis of acute central nervous system demyelination in children. UpToDate. 2012.
- Matiello M, Lennon VA, Jacob A, Pittock SJ, Lucchinetti CF, Wingerchuck DM, Weinshenker BG. NMO-IgG predicts the outcome of recurrent optic neuritis. Neurology. 2008; 70(23):2197-200.
- Olek MJ, Gonzalez-Scarano F, Dashe JF. Clinically isolated syndroms suggestive of multiple sclerosis. www.uptodate.com. 2013.
- Miller DH, Chard DT, Ciccarelli O. Clinically isolated syndromes. Lancet Neurol. 2012; 11.157
- Fisniku LK, Brex PA, Altmann Dr, Brex PA, Altmann DR, Miszkiel KA, Benton CE, Lanyon R, Thompson AJ, Miller DH. Disability and T2 MRI lesions: a 20-year follow-up of patients with relapse onset of multiple sclerosis. Brain. 2008; 131:808.
- Tintoré M, Rovira A, Río J, Nos C, Grivé E, Téllez N, Pelayo R, Comabella M, Sastre-Garriga J, Montalban X. Baseline MRI predicts future attacks and disability in clinically isolated syndromes. Neurology. 2006; 67:968.
- Optic Neuritis Study Group. The 5-year risk of MS after optic neuritis. Experience of the optic neuritis treatment trial. Neurology. 1997; 49:1404.
- Bruna J, Martínez-Yélamos S, Martínez-Yélamos A, Rubio F, Arbizu T. Idiopathic acute transverse myelitis: a clinical study and prognostic markers in 45 cases. Mult Scler. 2006; 12:169.
- Comi G, Martinelli V, Rodegher M, Moiola L, Bajenaru O, Carra A, Elovaara I, Fazekas F, Hartung HP, Hillert J, King J, Komoly S, Lubetzki C, Montalban X, Myhr KM, Ravnborg M, Rieckmann P, Wynn D, Young C, Filippi M; PreCISe study group. Effect of glatiramer acetate on conversion to clinically definite multiple sclerosis in patients with clinically isolated syndrome(PreCISe study): a randomized, double-blind, placebo-controlled trial. Lancet. 2009; 374:1503.
- Gajofatto A, Monaco S, Fiorini M, Zanusso G, Vedovello M, Rossi F, Turatti M, Benedetti MD. Assessment of outcome predictors in first-episode acute myelitis: a retrospective study of 53 cases. Arch Neurol. 2010; 67:724.
- Morrissey SP, Miller DH, Kendall BE, Kingsley DP, Kelly MA, Francis DA, MacManus DG, McDonald WI. The significance of brain magnetic resonance imaging abnormalities at presentation with clinically isolated syndroms suggestive of multiple sclerosis. A 5-year follow-up study. Brain. 1993; 116(1):135.
- Ford B, Tampieri D, Francis G. Long-term follow-up of acute partial transverse myelopathy. Neurology. 1992; 42:250.
- Confavreux Vukusic S, Moreau T, Adeleine P. Relapses and progression of disability in multiple sclerosis. Neurology. 2000; 343(20):1430-8.
- Tremlett H, Paty D, Devonshire V. Disability progression in multiple sclerosis is slower than previously reported. Neurology. 2006; 66(2):172-7.
- Lublin FD, Reingold SC, Cohen JA, Cutter GR, Sørensen PS, Thompson AJ, Wolinsky JS, Balcer LJ, Banwell B, Barkhof F, Bebo B Jr, Calabresi PA, Clanet M, Comi G, Fox RJ, Freedman MS, Goodman AD, Inglese M, Kappos L, Kieseier BC, Lincoln JA, Lubetzki C, Miller AE, Montalban X, O‘Connor PW, Petkau J, Pozzilli C, Rudick RA, Sormani MP, Stüve O, Waubant E, Polman CH. Defining the clinical course of multiple sclerosis: the 2013 revisions. Neurology. 2014; 83(3):278-86.